循環器各論―大動脈疾患
大動脈疾患
- 大動脈瘤
- 大動脈解離
- 大動脈炎症候群
今回は胸部大動脈瘤の合併症に関して説明します。
- 大動脈とは
- 大動脈瘤とは
- 有病率
- リスク因子・原因
- 分類
- 有病率
- リスク因子
- 症状
- 検査
- 治療・手術適応
- 合併症
合併症
内科的治療の合併症
内科的加療の合併症は大動脈瘤破裂です。
一度破裂してしまうと救命は非常に困難です。
症状出現時からの6時間以内の死亡率は50%にも上ります。
瘤径60mm以上は非常に破裂率が高くなるため、ガイドライン上でも手術適応は以下のように定められています。
無症状で胸部最大短径55 mm以上,あるいは6ヵ月で5 mm以上拡大する急速増大例では,侵襲的治療(外科手術,TEVAR)を考慮します。
(2回目)
外科的治療の成績と合併症
人工血管置換術、ステントグラフト治療ともに治療部位により合併症と予防方法が異なります。
✔︎人工血管置換術の成績
2016年の集計 日本胸部外科学会
非解離性大動脈手術の院内死亡率
- 非破裂例 上行3.0%、基部4.1%、弓部 6.2%、下行5.5%、胸腹部9.6%
- 破裂例 上行17.0%、基部19.2%、弓部16.9%、下行29.7%、胸腹部28.6%
破裂例の方が非破裂例より院内死亡率が非常に高いことがわかります。
そのため、破裂する前に手術することが大切です。
✔︎術後合併症と予防
- 上行弓部置換術―脳梗塞
- 下行大動脈―虚血性脊髄障害、腹部臓器血流、呼吸障害
脳梗塞予防
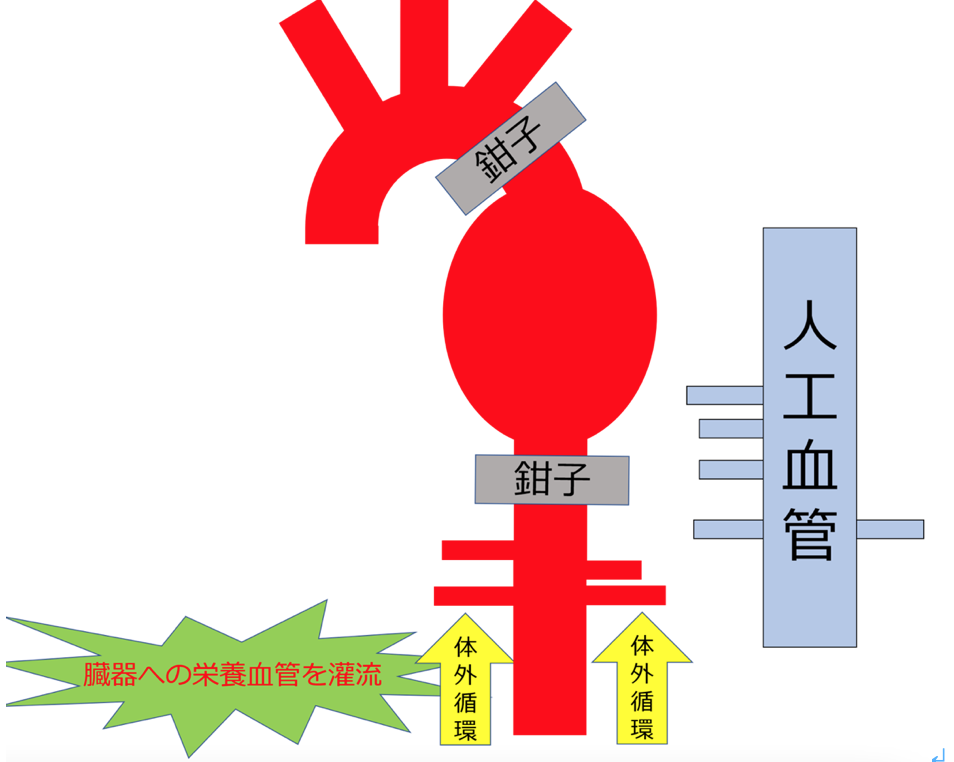
- 超低体温循環停止法―体温を20−22℃に下げて、酸素消費量・物質代謝の低下により循環遮断時間の延長をはかることです。
- 選択的順行性脳灌流法―20~22℃程度の低体温下にバルーン付きカニューラを腕頭動脈・左総頚動脈・左鎖骨下動脈に挿入し、10 mL/kg/minの流量を目安に順行性に脳を灌流する方法が一般的です。
- 逆行性脳灌流法―低体温は必須であると考えられており、18℃前後の超低体温下に上大静脈経由で中心静脈圧15~20 mmHgを目安に逆行性に脳を灌流することです。60分までという脳保護の時間的制約があると考えられています。
逆行性脳灌流法では選択的順行性脳灌流法と比べて一過性脳障害の発生増加が認められています。
虚血性脊髄障害
下行大動脈置換術では虚血性脊髄障害の予防が大切になります。
解剖学的に脊椎は大まかに前・側方に運動領域(図の青い部分)があり、後方に感覚領域(図の赤い部分)があります。
- 前脊椎動脈―脊髄の前部の約2/3に放射状に動脈を送り栄養しています。(図の青い部分)
- 後脊椎動脈―脊髄の後部の約1/3に放射状に動脈を送り栄養しています. (図の赤い部分)
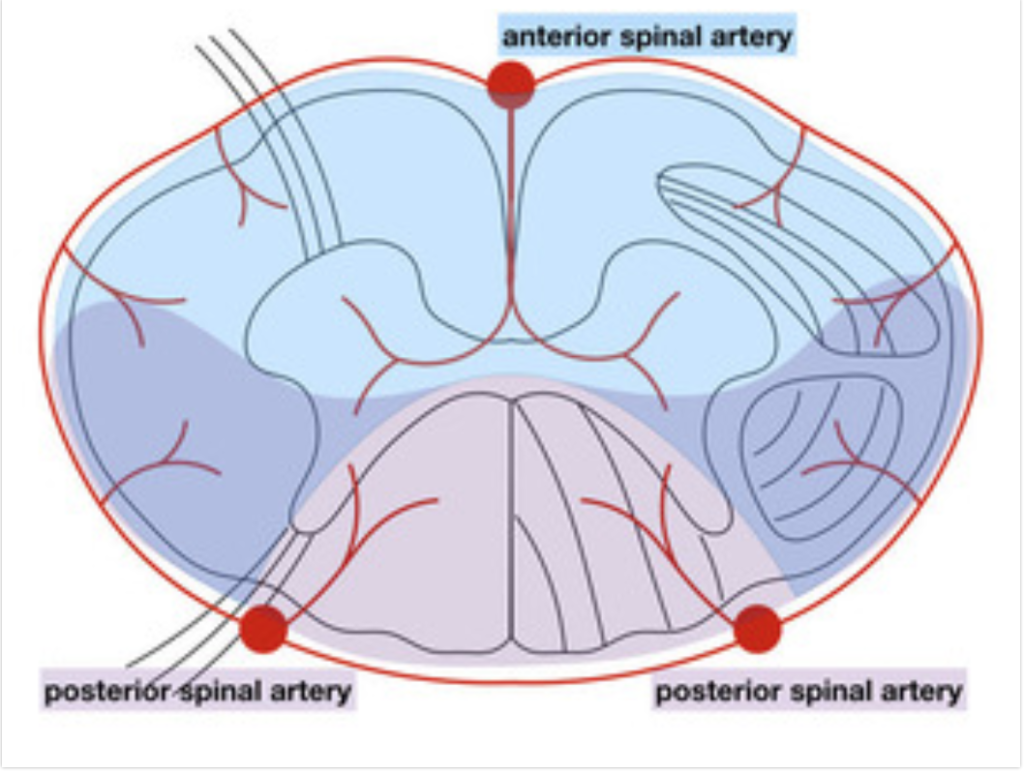
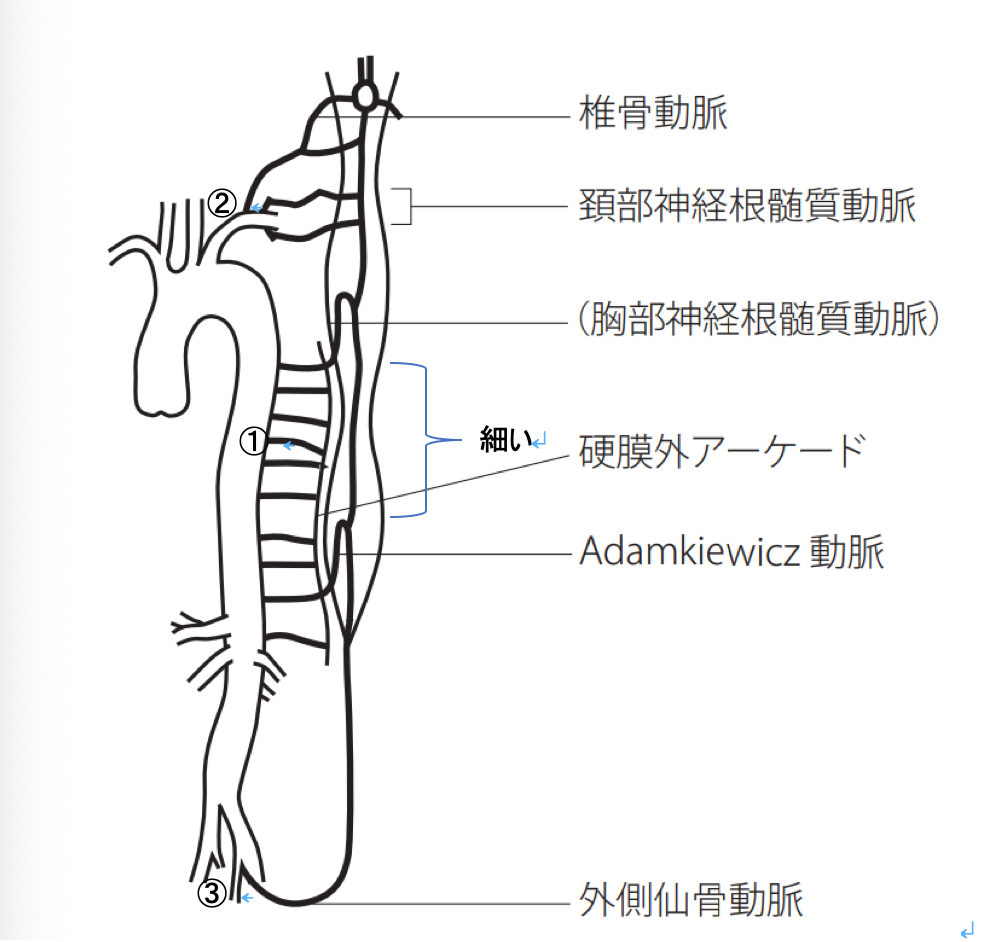
前脊椎動脈には①鎖骨下動脈・②前神経根動脈・③内腸骨動脈から血液が流れています。
T4レベルより尾側から細くなり、Adamkiewicz動脈合流部より尾側から太くなります。
そのため、長時間単純遮断などによる重篤な脊髄虚血ではT4レベル付近からの対麻痺が生じる可能性が高いです。
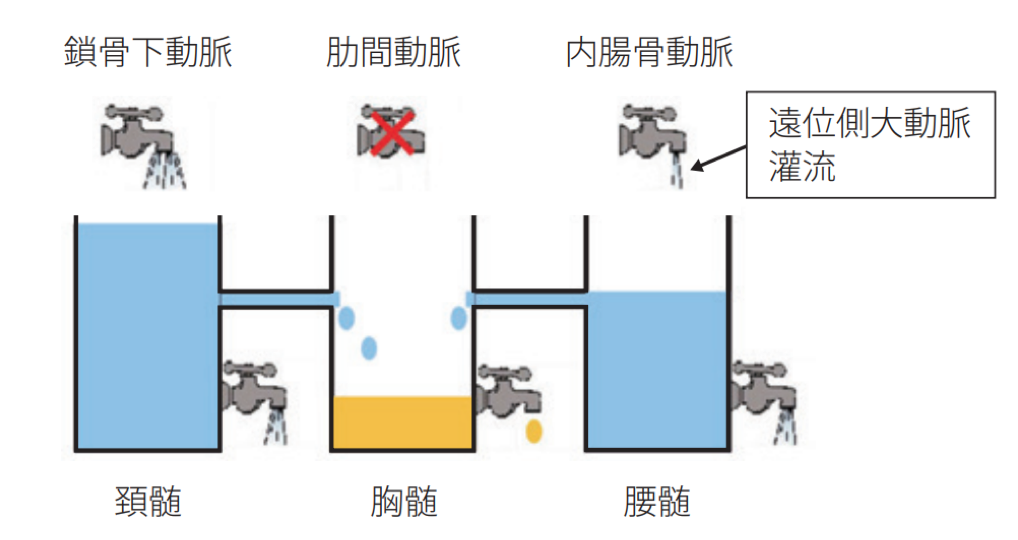
虚血性脊髄障害には即時性と遅発性があります。
- 即時性―術中の脊髄虚血により脊髄が不可逆的な障害をきたすものです。塞栓などによって生じるますが、一過性虚血であっても許容時間を超えると不可逆的障害をきたします。
- 遅発性―術後の栄養動脈閉塞・術後の脊髄浮腫に伴う髄腔圧上昇・血行動態悪化に伴う脊髄灌流圧低下などがあります。80%以上は分節動脈を再建しない術式やTEVARでなります。
術前CTで同定されたAdamkiewicz動脈の温存・再建は虚血性脊髄障害の発生率を低下させます。
また、TEVARであっても治療長が長く、開存しているAdamkiewicz動脈をカバーすることは虚血性脊髄障害が発生する危険因子です。
遅発性の予防として分節動脈非再建の場合は術後3日間は高血圧管理+脳脊髄液ドレナージを持続することが推奨されています。
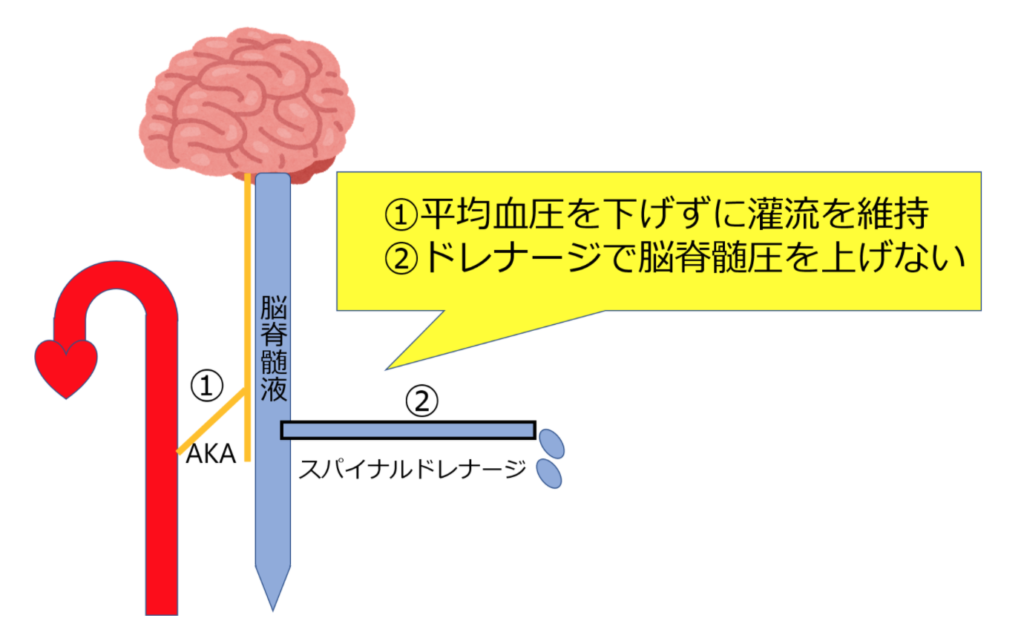
✔︎脳脊髄液ドレナージ
脊髄灌流圧は平均動脈圧と脳脊髄液圧の差で規定されます。
脊髄灌流圧=平均動脈圧―脳脊髄液圧
平均血圧を維持して、脳脊髄液圧をあげないように管理します。
灌流圧が50 mmHgより低下すると脊髄血流は低下し、15 mmHg以下では虚血性脊髄障害が発生します。
ドレナージ圧10~13 cmH2O以上、ドレナージ速度<15 mL/hが推奨されています。
腹部臓器血流
✔︎遠位側大動脈灌流(部分体外循環)
遠位側大動脈灌流(部分体外循環)とは脱血管と送血管を大腿動脈に挿入して、下半身の血流を維持することです。FFバイパスともいいます。
主な目的は分節動脈再建中も含めた大動脈遮断中の脊髄側副血流量・腹部臓器血流量を高く保つことです。
また、以下のような利点もあります。
- 心臓前負荷と灌流量を独立して調節可能
- 人工肺による呼吸補助が可能(片肺換気中の換気悪化に対処できる)
- 超低体温への移行が容易
- 術野血の回収返血が可能(大出血に対処できる)
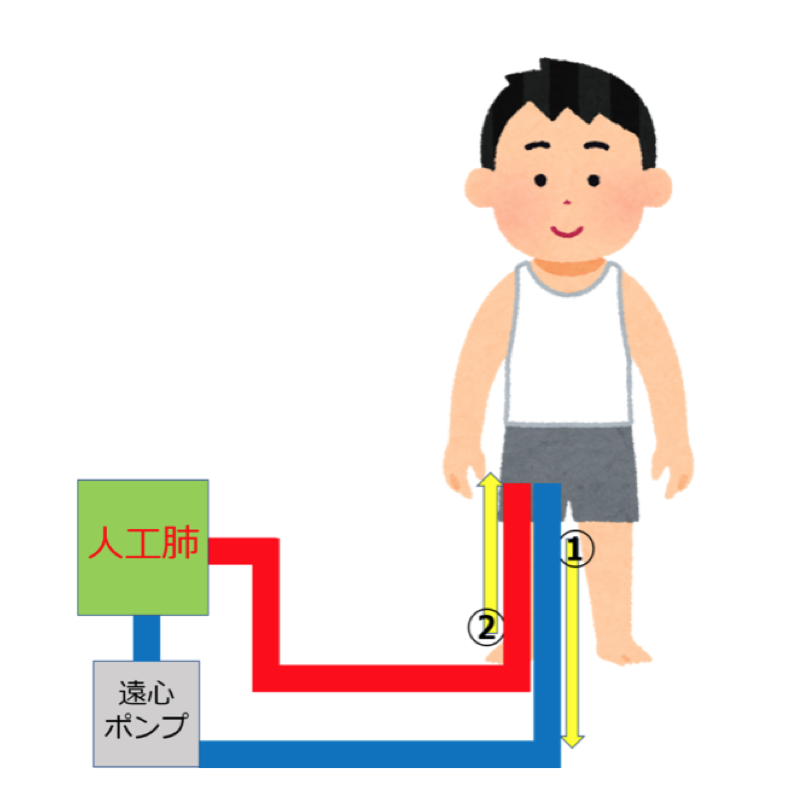
腎灌流量は正常の25-50%が至適であり、4分枝総計で600-800mL/分の灌流量が用いられる
呼吸障害
弓部下行大動脈は解剖学的に左胸腔より背側に位置するため、術中に左肺が換気されていると視野の妨げになります。そのため、分離肺換気を行うことで左肺を換気せず(空気を入れず)、右肺のみを換気することができます。
分離肺換気の方法としてはダブルルーメンチューブを用いるのがゴールドスタンダードです。
ダブルルーメンチューブの90-95%は左用です。解剖学的に右主気管支長は左主気管支長よりも短く右用ダブルルーメンチューブの安全域が狭いためです。
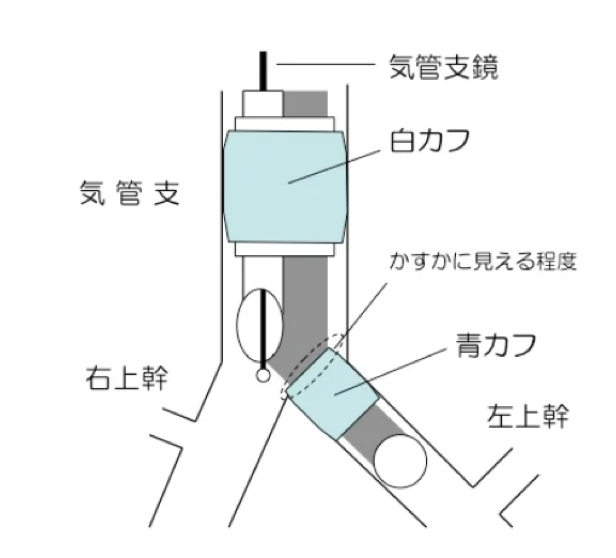
利点
- 術中の視野の確保
欠点
- 右肺に呼吸器疾患がある場合は使用要検討
- 術中の酸素化の維持
- 術後胸水が貯留
- 術後無気肺の発生
- 術後喀痰の増加
✔︎2016年の集計 日本胸部外科学会 ステントグラフト治療の成績
- 院内死亡は4.8%、脳卒中は4.0%、SCIは2.7%である
- 脳卒中発生率ー中枢側landing部Zone 0~2 (弓部)―7.6% Zone 3以遠(下行)―1.6%
✔︎術後合併症
- 逆行性A型大動脈解離を代表とする急性大動脈症候群の発生
- エンドリーク(type I ~ V)、re-entry flow
- 脳卒中
- 脊椎虚血
- アクセストラブル(血管損傷)
- 局所性DIC(消費性凝固障害)
ステントグラフト治療特有のエンドリークもあります。
✔︎エンドリーク
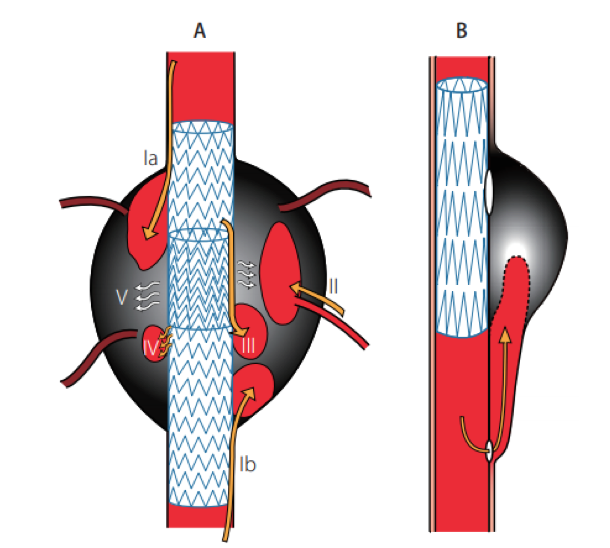
A
- Type I:動脈壁とステントグラフトの接合部分からの血液漏れで瘤内に血液が流れ込むもの。中枢側からのものをType Ia、末梢側からのものをType Ibといいます。
- Type II:大動脈瘤の側枝(肋間動脈など)から血液が逆流して瘤内へ流れ込むもの
- Type IIIa:ステントグラフト間の接合部分からの瘤内への血液漏れ
- Type IIIb:ステントグラフトの破損などにて瘤内に血液が流れ込むもの
- Type IV:ステントグラフトのポロシティ(人工血管基布に開いている小孔)からの血液漏れ
- Type V:瘤内に血流が認められないにもかかわらず、瘤が拡大傾向を示すもの
B
TEVARによる entry 閉鎖後の re-entry flow
胸部大動脈疾患に対するTEVARは、いまだその歴史が浅く、外科手術や保存的治療との比較により適応や方法において、今後変更される可能性があります。
CTによるフォロー期間
✔︎治療前
- 大動脈基部・上行大動脈瘤:35~45 mm未満は 6~ 12ヵ月ごと、45~55 mm未満は3~6ヵ月ごと
- 遺伝性結合織疾患が疑われる大動脈基部・上行大動脈瘤:35~40 mm未満は 6~12ヵ月ごと、40~50 mm 未満は3~6ヵ月ごと
- 胸部弓部・下行大動脈瘤:45 mm未満は12ヵ月ごと, 45~55 mm未満は3~6ヵ月ごと
✔︎治療後
ステントグラフト内挿術
ステントグラフト治療は人工血管置換術と異なり根治的治療ではないためエンドリークの発生により繰り返し手術する可能性があります。
TEVAR後のCT検査は、1・6・12ヵ月後、その後は年1回が推奨されます。
人工血管置換術
人工血管置換術術後も吻合部瘤人工血管感染などの合併症や人工血管置換部と離れた場所での大動脈疾患の増悪・新規発症する可能性があるため、原則として1・6・12ヵ月後と12ヵ月後以降は年1回の画像検査によるフォローアップを行います。
今回はこれで終わります。お疲れ様でした。




コメント